研究内容
当研究室では、体の生理変化に伴う臓器リモデリング機構について研究を行っています。 妊娠・老化・肥満などのライフコースで起こる生理変化に応じて、血管/神経/免疫/間質/上皮細胞などの異種細胞間ネットワークが、 組織内のメカノフィールドや液性因子と連携して組織・臓器を再編成する仕組みとその生理機能について解析しています。 生体内に備わる臓器リモデリング機構を利用した再生医療技術・治療薬の開発を目指しています。 また、これらの研究開発を支える遺伝子改変技術の開発を行っています。
研究項目:
1.妊娠における母体臓器リモデリング機構
2.老化・肥満における臓器リモデリング機構
3.臓器リモデリング機構を利用した再生医療の基盤開発
4.CriMGET systemによる遺伝子ターゲテイング技術の開発
1.妊娠における母体臓器リモデリング機構
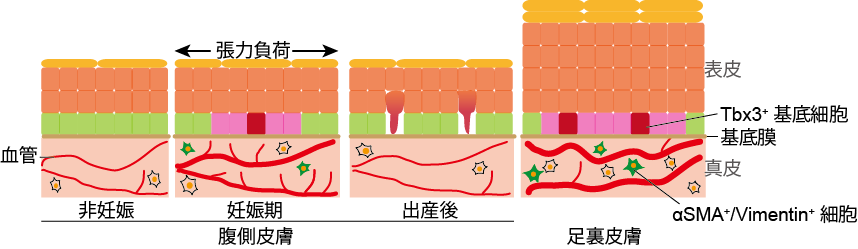
妊娠期には、脳、肝臓、心臓、胸腺、乳腺など母体の様々な臓器が形態と機能を変化させます。 このような母体臓器リモデリング機構は、妊娠の成立、妊娠期特有の代謝機能の獲得、胎児の発生・成育を支える母体機能に必須ですが、 各臓器を構成する細胞の時空間制御機構、細胞不均一性と階層性、多種細胞間の相互作用、母体-胎児連関など、細胞・発生生物学的アプローチ に基づく母体機能研究は立ち遅れています。近年、妊娠期には、神経幹細胞、乳腺幹細胞、造血幹細胞などの組織幹細胞の増殖・分化が亢進することが 報告され、組織幹細胞を基軸とした臓器リモデリング機構の存在が明らかになってきました。 当研究室では、妊娠期に急速に拡張する母体の腹部皮膚において、表皮幹細胞から増殖性の高いTbx3陽性の基底細胞が産生されることを見出しました。 この細胞群の出現は真皮細胞が分泌するIgfbp2などの液性シグナルに依存することを報告しました(Ichijo et al., Nat Commun. 2017)。 また、妊娠期には腹部皮膚において体表血管が増加し、血管に依存的してTbx3陽性基底細胞が出現し、出産後には血管が退縮するとともに Tbx3陽性基底細胞が分化して表皮から排出されることが分かりました。また、足底部表皮のように、表皮が厚く新陳代謝の高い体表領域では 体表血管が発達しており、Tbx3+基底細胞が幹細胞として恒常的に維持されていました。このことから、血管が真皮と表皮のリモデリングを誘導し、 生理変化や体表領域に合わせた皮膚の伸展や新陳代謝を制御していることが明らかとなりました(Ichijo et al., Sci. Adv. 2021)。 現在、血管と力場による皮膚リモデリング機構、ならびに母体皮膚リモデリングと胎児発生の関連について研究を進めています。
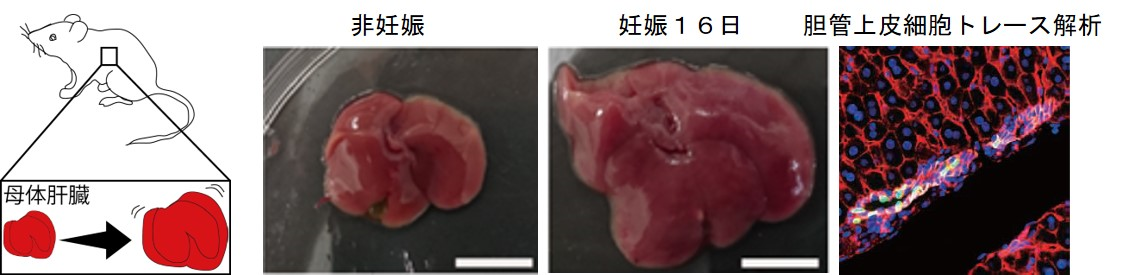
妊娠期には、母体の肝臓が肥大化することが知られています。この肥大化には、肝実質細胞である肝細胞の増殖と細胞サイズの拡張が伴います。 当研究室では、妊娠期の肝臓リモデリングを担う、肝細胞と非肝実質細胞の連携機構について研究を進めています。 これまでに、肝臓の胆管上皮細胞が妊娠初期に一過的に増殖し自己複製すること、この増殖はYAP依存的であり、 YAPの機能を阻害すると妊娠初期における肝臓の肥大化が抑制されることを見出しました(Koduki et. al., Genes Cells 2021)。 現在、妊娠期における肝細胞の時空間ダイナミクス制御機構ならびに母体生理における役割について研究を進めています。
2.老化・肥満における臓器リモデリング機構
老化と肥満における皮膚の変性機構について、組織幹細胞、メカノバイオロジー、慢性炎症の観点から研究を行っています。表皮幹細胞は加齢によって機能が低下し、ヘミデスモソームを介した基底膜との接着が弱くなり、細胞分裂の方向性も異常になることが知られています。 この表皮幹細胞の加齢変容は、酸化ストレスなどによって生じるDNA損傷など細胞内部の変化が要因であることが報告されていました。しかし、表皮幹細胞を取りまく周囲の環境の加齢変化やそれが表皮幹細胞に及ぼす影響については未解明でした。 当研究室では、加齢に伴う真皮の硬化が表皮幹細胞におけるメカノセンサーPiezo1の長期活性化を誘発し、これが原因となって表皮幹細胞の早期分化とヘミデスモソームの脆弱化が引き起こされることを見出しました。 また、加齢に伴う真皮の硬化は体表血管の減少に起因しており、血管減少を誘導する液性因子として、線維芽細胞から分泌されるPtx3を同定しました (Ichijo et. al., Nature Aging 2022)。 Ptx3はマウスだけではなく高齢者の皮膚でも蓄積しているため、ヒトの皮膚老化の原因の1つとなっている可能性があります。Ptx3や血管を標的としたシーズ開発を実施することで、老化による創傷治癒遅延を回復させる技術や医薬品の開発につながることが期待されます。
3.臓器リモデリング機構を利用した再生医療の基盤開発
妊娠期における組織幹細胞の挙動は、損傷応答時や胎生期における幹細胞の挙動との共通性が認められます。 妊娠の腹部皮膚表皮で発見された増殖性の高いTbx3+基底細胞は、発生過程の胎児皮膚表皮にも多く存在します(Ichijo et. al., Genes Cells 2017)。 また、創傷治癒時にもTbx3+基底細胞は出現し、表皮特異的にTbx3をノックアウトすると創傷治癒が遅延し、真皮シグナル(Igfbp2)の塗布により Tbx3+基底細胞 を誘導すると、創傷治癒を早める効果があることが分かりました(Ichijo et al., Nat Commun. 2017)。 妊娠に伴う幹細胞増殖は腫瘍化を誘導せず、出産後には定常状態に戻ります。この性質を利用して、妊娠期の幹細胞増殖・分化制御機構を生体内で 再現することにより、低リスクに臓器リモデリングを操作する再生医療技術の開発を進めています。 また、損傷修復過程の組織分泌液中から上皮バリアであるタイトジャンクション(TJ)の形成を誘導する生理活性ペプチドを発見し、 JIP(Junction inducing peptide)と名付けました。JIPは、Gタンパク質G13を直接活性化することでアクチン骨格を再編成し、 TJの形成を誘導することが分かりました。JIPは、DSS誘導性腸炎モデルに対して治癒効果を持っており、 バリア破綻を伴う炎症性疾患に対する創薬シーズとして期待されます(Oda et. al., Sci. Adv. 2021)。
4. CriMGET systemによる遺伝子ターゲテイング技術の開発
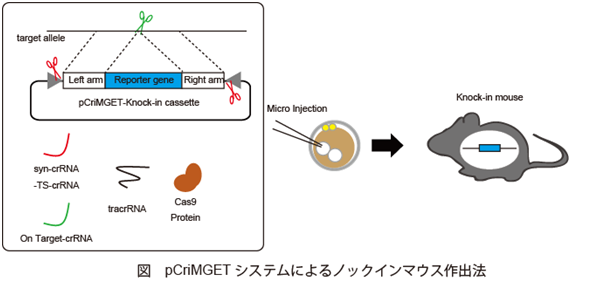
マウスとヒトのゲノム上でのオフターゲットを最小化した人工CRISPR/Cas9切断配列(Syn-crRNA-TS (Synthetic crRNA target sequence))をデザインし、 これをマルチクローニングサイト(MCS)の両端に配した汎用性の高いドナープラスミドpCriMGET (plasmid of synthetic CRISPR coded RNA target sequence-equipped donor plasmid mediated gene targeting) を開発しました (Ishibashi et. al., Sci. Rep. 2020)。 pCriMGETシステムにより、 遺伝子導入コンストラクトの作製や遺伝子改変個体樹立後の核型判定にかかる時間と労力ならびにコストを大きく削減することが可能となりました。 現在、より汎用性を高めたpCriMGETシステムを開発しています。
以前の研究
細胞分裂軸を制御する分子メカニズム
多細胞生物の様々な臓器では、細胞がある決められた軸方向に沿って分裂しています。 この「細胞分裂軸」の方向制御は、幹細胞の分化や組織の形態形成に必須の役割を果たします。 私たちの研究室ではこれまでに、 細胞外基質への接着が細胞の分裂軸を決めるメカニズムについて、 培養細胞を用いて研究を行ってきました。 まず、接着細胞をフィブロネクチン等の細胞外基質の上で培養すると、 分裂期に形成される紡錘体が基質に対して平行に配置されて 水平に分裂する現象を発見しました。 この現象は、分裂後に二つの娘細胞が共に基質に接着するのに必要であり、 細胞接着因子インテグリンβ1に依存することを報告しました (EMBO J., 2007)。 次に、細胞膜リン脂質PIP3がアクチン制御因子Cdc42依存的に、 ダイニンモータータンパク質を細胞表層の中央領域に濃縮させ、 紡錘体にかかるけん引力を基質に対して平衡することが分かり、 細胞膜脂質と細胞骨格のクロストークが分裂軸を制御することを明らかにしました (Dev. Cell, 2007; Mol. Cell Biol., 2009)。 続いて、siRNAライブラリーを用いたゲノムワイドのスクリーニングを実施し、 複数の新規分裂軸制御因子を同定しました。 このうち、ABL1は分裂軸制御因子NuMAを直接リン酸化すること、 PCTK1はPKA- MyosinX-インテグリンを介して 分裂軸を制御することを報告しました (Nat. Commun., 2012; Mol. Cell Biol., 2015)。 さらに、細胞外基質の幾何学情報は、caveolin1を介して、 分裂軸制御複合体Gα/LGN/NuMAに伝達されることを明らかにしました(Nat. Commun., 2016)。 細胞分裂軸は、 幹細胞の対称・非対称分裂の振り分けに重要です。我々は、マウスES細胞を中胚葉と内胚葉へ分化させるin vitro分化系において、 分裂軸制御因子であるmInscが転写因子c-Rel依存的に一過的に発現上昇し、中胚様への分化を促進することを報告しました(J. Biol. Chem., 2016)。