研究内容
■ タンパク質の凝集メカニズムとその疾患の研究(現在作成中)
「タンパク質が凝集する」という言葉に対して、みなさんはどのようなイメージを抱かれますか?私は、タンパク質が凝集する事によって生じる疾患に関する研究に従事しています。
タンパク質凝集性疾患とは、実に広いサイエンスの舞台です。広いというのは、先天的な遺伝子配列の異常から、後天的な生活習慣の影響や老化まで、それらを原因として起こってしまう病気です。
是非、その概念を理解いただくために、まずは我々の日常生活に身近な、食品タンパク質の凝集について語らさせてください。
[研究の背景は私が歩んで来た歴史そのものかもしれない]
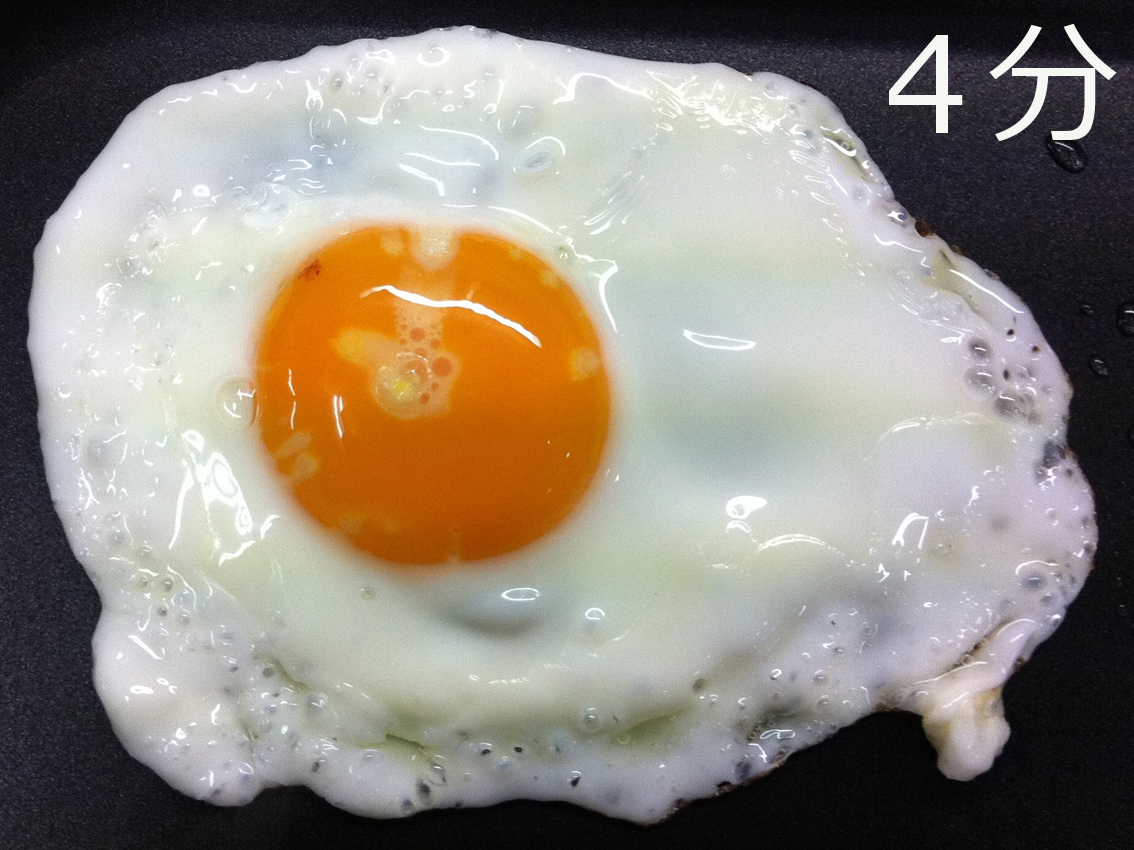
思い返せば15年前、私がタンパク質構造の研究を始めた時、最初の作業は鶏の卵を買いに行く事でした。その時は考えもしなかったのですが、、日常生活で誰もがなじみ深い目玉焼き、実はこれは見事にタンパク質凝集のサイエンスを表現していました。
卵白タンパク質はその約60%をオボアルブミンが占めます。つまり、フライパン上におけるタンパク質の熱変性・共凝集を主導するという事を意味します。脇役もなかなか有名です。オボトランスフェリンは鉄を強く結合する能力を持ちます。リゾチームは細胞の細胞壁を分解する能力を持ちます。共に、微生物の生育を阻止し卵黄を保護するのに重要です。意外と知られていないのが、皆さんのご家庭に届く頃、卵白のpHは10前後と極めてアルカリ性であることです。つまり卵白の変性・凝集はアルカリ環境で進んでいくのです。
一方、卵黄の変性・凝集を見てみてみましょう。水分が90%、脂質がほぼ0%という卵白の環境に比べ、卵黄の環境は、水分が50%、脂質が30%と大きく異なります。卵白がメレンゲなど軽やかな物性を醸し出すのに対し、卵黄が食品に粘性・コクを与えるのも納得です。ちなみにpHは中性であり、タンパク質組成も全く別物です。
ここでさらに重要なのは、卵黄膜の存在により、卵黄タンパク質は卵白から地理的に隔離されていることにあります。なるほど数ある卵料理のサイエンスの中でも、目玉焼きはフライパンという熱源からの経路の違いを除けば、ほぼ独立2系統の凝集現象と言えます。
いや、濃厚卵白の存在を鑑みれば。3系統かもしれません。
鶏卵の調理法は、他の食品と混合した場合を含めほぼ無数にあります。そこで定義されているのは、タンパク質の組み合わせからそれらの変性・凝集までの環境にあります。これに尽きるのです。熱する時間に応じて、その凝集状態は変化を続けている訳です。
さあ、少なくともあなたの目玉焼きに対する視点は変化してきたでしょうか?


奇しくも私が、学士で栄養化学を学び、修士で食料科学研究所に在籍したため、少々話は脱線したかもしれません。そろそろ話をタンパク質凝集性疾患に戻しましょう。
[タンパク質が凝集する事によっておこる病気とは一体何でしょう?]
さて、人体においてタンパク質はどのように凝集するのでしょう?鍵となるのは我々の遺伝子配列の変化です。その異常化の度合いとタンパク質凝集性疾患の例とを関連付けながらここで紹介しましょう。
(1)大規模な配列異常によりタンパク質が凝集:ハンチントン病
ハンチンチンというタンパク質の前半領域にグルタミン酸配列が挿入してしまうことで大脳の神経細胞で凝集が起こり全身の不随運動に至ります。興味深いのは、どうやらグルタミン酸が36リピート以上挿入すると疾患を引き起こす事です。つまり、36以下のグルタミン酸の挿入という異常には耐えうるシステムを我々のカラダは持っているということになります。逆に上限としては、800以上のグルタミン酸が挿入した例も報告されており、挿入数が多いほど早く疾患に陥ります、また疾患のタイプも異なります。別名ポリグルタミン酸病と呼ばれます。しかしながら、大規模な配列異常がタンパク質の構造を滅茶苦茶に破壊してしまうことは、皆様にとっても容易に想像できますよね。
(2)ごく小さな配列異常によりタンパク質が凝集:パーキンソン病、セルピン疾患
(3)自らは正常であるが、周りにより凝集へと導かれる:アルツハイマー病、プリオン病
一番迷惑なパターンがこれです。タバコの副流煙で肺ガンになるようなものです。しかし、ご存知の様に、アルツハイマー病は現代で最も有名な疾患の一つです。そして、1980年代よりタンパク質凝集病の顔として世界を恐怖に陥れた狂牛病は、そろそろ完全に消滅いただきたいが、まだまだ研究の余地、感染の可能性がある疾患であります。
このケースにおける問題は何でしょうか?そのタンパク質が存在する空間・環境が異常なのです。アルツハイマー病の原因の一つして知られるAbetaペプチドを含有するタンパク質に異常はありません。しかし、そのペプチドを切り出してしまう異常な酵素が患者には存在するわけです。狂牛病の感染とは何でしょう?我々あのカラダにおけるほぼすべての細胞に存在するプリオンタンパク質にはなんの問題もありません。しかし、我々のカラダの外からやってくる(主に感染性の凝集物を含んだ食肉を我々が食する事によります。しかし、最近はその粉砕物が空気中に浮遊するだけで感染する可能性があると言われています。)因子が彼らを凝集へと導く訳です。ここで興味深いのは、Abetaペプチドやプリオンタンパク質は、もともと我々のカラダでどの様な働きを持っているのか?と言う事であります。これは実は、はっきりとは解明されておりません。しかし、その機能不全がこれら疾患の直接原因となる可能性があり、解明すべき事象であると考えています。
さて、ご理解いただけたでしょうか?先に述べた、食品の加工において様々な環境がタンパク質の凝集とその物性の創出に影響を持つ可能性がある様に、我々のカラダでも様々な原因、言わば環境がタンパク質の凝集とその疾患を引き起こすのです。それらを的確に選別していくことが、これからの凝集サイエンスには必要ではないでしょうか?
そろそろ、私が近年イギリスでの研究生活により明らかにした事柄を紹介させてください。それは欧米で非常に有名な「アンチトリプシン欠損症」という疾患の基盤を成す凝集体の形成メカニズムの解析です。