
研究内容
基盤研究
「CD1バイオロジーと結核免疫」
CD1分子とは? ~抗原提示の新たなパラダイム~
MHC分子が蛋白質断片であるペプチド抗原を結合してT細胞に抗原提示する現象は、近代免疫学における中心的パラダイムのひとつであり、特異的な生体防御機構の根幹をなすものと考えられてきた。微生物が産生する蛋白質抗原を認識するMHC拘束性エフェクターT細胞の誘導は、脊椎動物が進化の過程で発達させてきた適応免疫システム(adaptive immunity)であり、特異性の高い効率的な感染制御を可能にする。逆に一部の病原性微生物は、MHC分子と抗原ペプチドの生成や細胞内輸送経路をさまざまなステップで阻害する能力を獲得してきた。さらに、MHC拘束性T細胞による抗原ペプチドの認識は特異性が極めて高いため、微生物は抗原ペプチドをコードする遺伝子の変異を繰り返すことにより、MHC分子を介した免疫監視を容易に免れることができる。したがって、効果的な宿主防御のためには、MHC非依存性の適応免疫システムの存在が必要であろう。そのような免疫応答を担う分子として、ヒトグループ1CD1分子(CD1a、CD1b、CD1c)が同定された。CD1分子は、非蛋白・非ペプチド抗原である脂質を結合し、T細胞に抗原提示する新しいタイプの抗原提示分子である(図1)。CD1分子は、適応免疫応答の鍵となる樹状細胞に発現する。
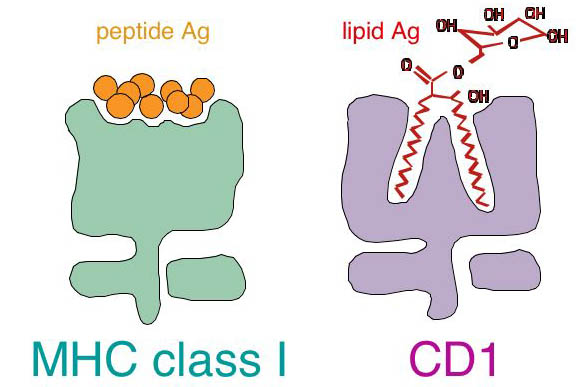 図1
図1
CD1分子による脂質抗原提示 ~樹状細胞の新たな機能~
末梢血単球はグループ1CD1分子を発現しない。しかし、これらの細胞をGM-CSFとIL-4の存在下で数日間培養すると、樹状細胞に分化するとともに、グループ1CD1分子を発現するようになる。この事実は、樹状細胞への分化とグループ1CD1分子の発現が、密接にリンクした現象であることを物語る。体内の多くの組織、臓器に存在する樹状細胞は、細胞表面に多数の樹状突起を有し、抗原を効率的に取り込むことができる(図2)。
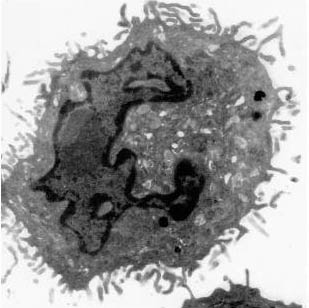 図2
図2
取り込まれた抗原は、細胞内のエンドソームやリソソームで分解(プロセシング)されたのち、MHCやCD1などの抗原提示分子と結合し、T細胞に抗原提示される。このステップを経て、抗原特異的免疫応答が活性化され、効率的な生体防御反応が誘導される。たとえば、表皮樹状細胞であるランゲルハンス細胞に高発現したCD1a分子(図3、図4)は、古くからランゲルハンス細胞のマーカー蛋白として利用されてきたが、その機能は不明であった。私たちの研究から、ランゲルハンス細胞に発現したCD1a分子は、細菌脂質の抗原提示を担い、特異的なT細胞の活性化を通して、皮膚免疫に深く関わっていることが明らかとなっている。
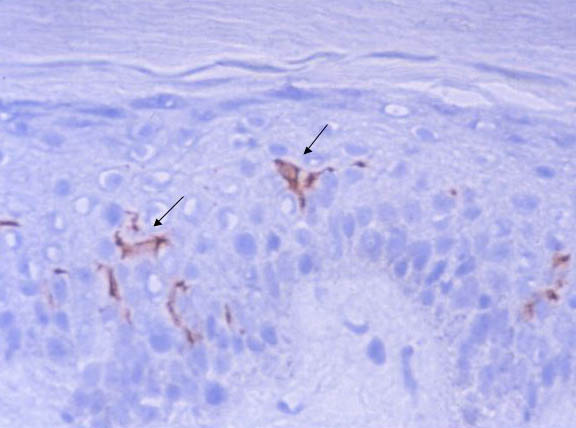 図3
図3 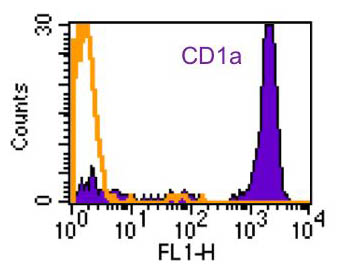 図4
図4
なぜ複数のCD1分子が存在するのか? ~CD1分子の細胞生物学~
脂質抗原を提示するのに、なぜ複数のCD1分子(ヒトではCD1a、CD1b、CD1c、モルモットでは7つのCD1分子が存在する)が必要なのだろうか。その手がかりは、CD1分子の細胞内輸送、細胞内発現分布を検討することにより得られた。CD1a分子とCD1b分子の細胞内発現をconfocal microscopyで観察すると、両者は全くことなる分布を示す(図5)。CD1b分子を発現した小胞はリソソームのマーカーであるLAMP-1を同時に発現している(図5下段)ことから、CD1b分子はリソソームに選択的に発現することが判る。一方、CD1a分子を発現した小胞は、LAMP-1の発現を欠くことから、リソソームとは異なるコンパートメントに属する(図5上段)。この実体は、リサイクリングエンドソームと呼ばれる早期エンドソームである。
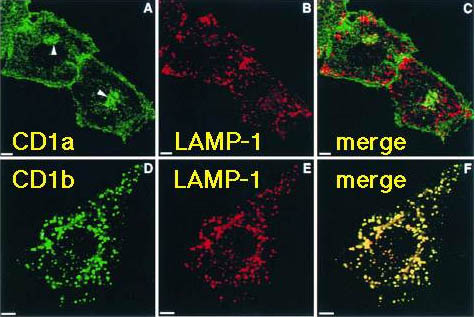 図5
図5
CD1分子は、細胞表面のクラスリン被覆小胞から細胞内にエンドサイトーシスされる(図6)。細胞内に取り込まれたCD1分子は、ソーティングエンドソームに運ばれ、ここからの行き先は大きく二手に分かれる。AP-3と呼ばれるアダプター蛋白と結合するCD1b分子(図7、yeast 2-hybrid 解析参照)はリソソームに運ばれるのに対し、AP-3と結合しないCD1a分子、CD1c分子は主にリサイクリングエンドソームに運ばれる。このことは、脂質抗原提示において重要な意味を持っている。脂質抗原のうち、長い炭素鎖を有するものは選択的にリソソームに運ばれるのに対し、短い炭素鎖を有するものはリサイクリングエンドソームに運ばれる。したがって、この両者にCD1分子が発現することは、構造の異なる脂質抗原を漏れなくサンプリングするのに適している。AP-3遺伝子に変異を持つ遺伝病であるHermansky-Pudlak症候群2型患者においては、CD1b分子がリソソームに到達できず、結果としてCD1b分子を介した抗原提示が損なわれる。本疾患患者に認められる細菌に対する易感染性は、CD1b分子の機能不全に起因すると考えられる。言い換えれば、CD1分子を介した脂質免疫応答が生体防御に重要な役割を果たしていることを示している。
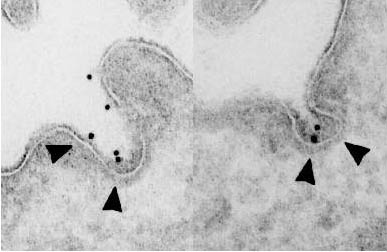 図6
図6
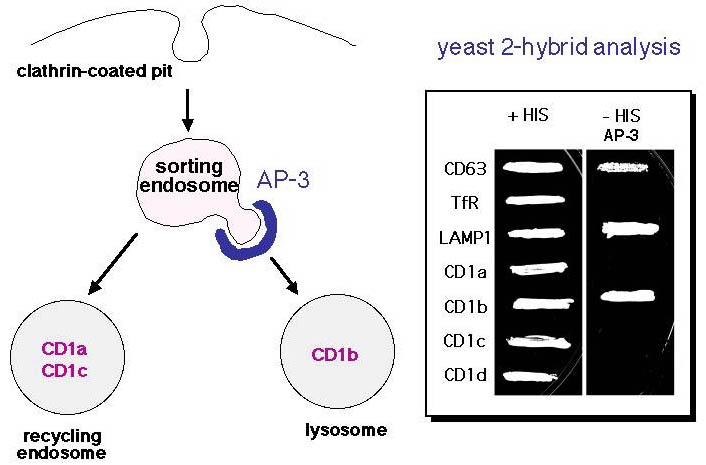 図7
図7
結核免疫におけるCD1分子の重要性 ~新たなワクチン開発を目指して~
これまで同定された、グループ1CD1分子によって提示される脂質抗原の多くは、結核菌など抗酸菌由来である。結核菌は宿主細胞内のファゴゾームで分裂増殖する細胞内寄生細菌であり、ファゴゾーム・リソソーム融合阻止やファゴゾーム酸性化の阻害、蛋白抗原の細胞質への漏出阻止などを通して、MHC分子を介した免疫監視を効果的に免れる機構を獲得している。したがって、宿主はMHC非依存性の抗原提示経路、すなわちCD1分子を介した脂質抗原提示経路を積極的に活用しているものと推察される。結核菌は脂質に富む厚い細胞壁を有している(図8*印)ため、酸性環境や化学物質の暴露に対しても抵抗性を示し、結核菌が宿主細胞ファゴゾーム内で、長年にわたって生存できる大きな要因となっている。結核菌細胞壁には、ミコール酸やリポアラビノマンナンなど、結核菌の生存や病原性の発揮に必須の脂質が存在し(図9)、これらの脂質抗原をT細胞に提示する分子がCD1分子である。
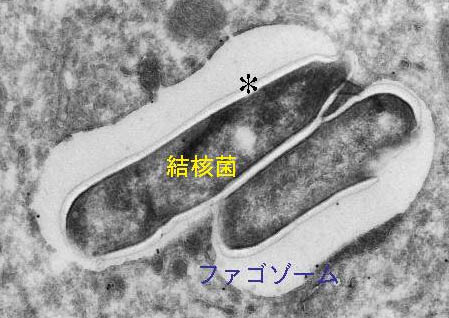 図8
図8
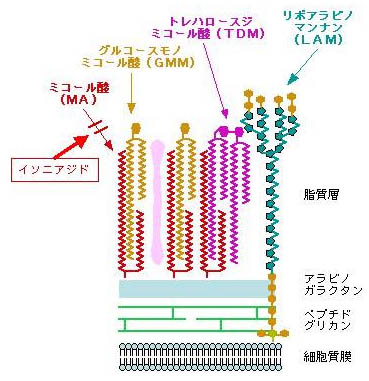 図9
図9
結核菌の生存に必須の脂質分子をターゲットにした免疫応答は、有効な感染防御機構になることは容易に予想される。実際、結核菌感染樹状細胞を特異的に認識して活性化されるCD1拘束性キラーT細胞の存在が実証された(図10)。これらのT細胞は、感染細胞にアポトーシスを誘導し排除するとともに、グラニュリシンという殺菌物質を産生する。さらに結核免疫に最も重要なサイトカインであるインターフェロンガンマを産生することにより、防御免疫を増強する。これらの事実は、結核免疫におけてCD1分子が critical な役割を果たしていることを示すだけでなく、「脂質」が抗結核ワクチンの新たなターゲットとなる可能性を物語っており、現在精力的に研究を展開している。
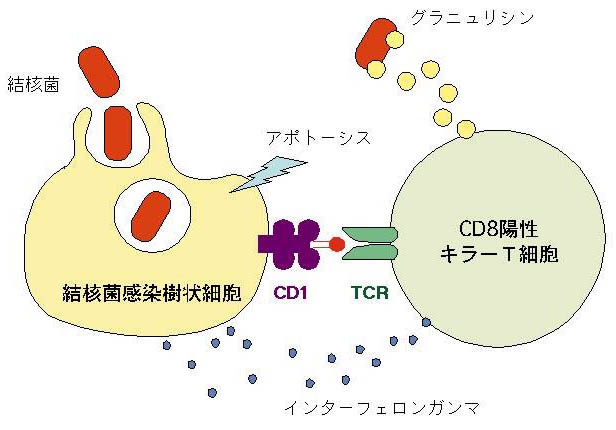 図10
図10
CD1分子による生体制御 ~適応免疫を担う2本の柱~
これまでの結核研究をもとに、適応免疫は、蛋白抗原に対するMHC依存性経路と脂質抗原に対するCD1依存性経路が相乗的に機能することにより成立していると考えられるようになった(図11)。
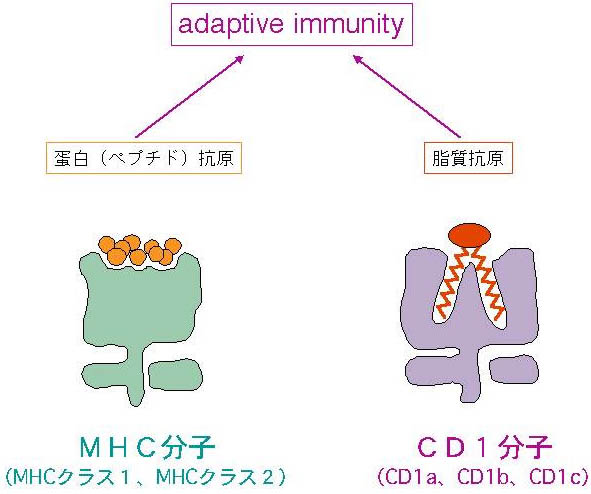 図11
図11
ではCD1分子は果たして結核免疫のためだけに存在しているのだろうか。結核菌が人類の歴史において多大な脅威であったことは認めるにしても、CD1が結核免疫のためだけに進化の過程で維持されてきたとはとても考えられない。ウイルス感染や腫瘍免疫におけるCD1分子を介した免疫応答の存在とその制御法の確立を目指し、CD1トランスジェニックマウスやモルモットの詳細な免疫解析を進めている。また脂質に対する過剰な反応は、アレルギーや自己免疫疾患を惹起する。臨床の先生方との共同研究を通して、これまでの基礎研究の成果を基盤とした臨床研究を展開している。
