
エッセイ
2015年ウイルス研究所アニュアルレポート 研究室紹介
MHC分子は、タンパク質断片であるペプチドを結合し、T細胞に抗原提示する。これによって活性化したタンパク質抗原特異的T細胞は、標的細胞の傷害やさまざまなサイトカイン産生を通して、有効な獲得免疫を成立させる。一方、私たちの研究室では「脂質免疫」を切り口として、タンパク質免疫と対峙する獲得免疫経路の研究を展開してきた。ヒトグループ1CD1分子が結核菌由来の脂質を結合し、脂質特異的T細胞応答を誘起することは、これまでもAnnual Reportの紙面で紹介してきた通りである。つまり、獲得免疫はタンパク質を標的としたMHC依存的経路と脂質を標的としたCD1依存的経路の総和として成立するという発想であった。今回、旧来のMHC概念だけでなく、私たちが描くMHC/CD1両立パラダイムすら修正が必要となる新しい発見があった。
ウイルス感染防御における脂質免疫の存在や意義を考え始めたのは、2005年頃であったと記憶している。ウイルスには固有の脂質などない、したがって脂質免疫は存在しない、と誰もがそう考えていた。しかし、たとえばエイズウイルスNefタンパク質が免疫抑制機能を発揮するためには、脂質修飾(ミリスチン酸修飾)を受けることは必須である。脂質修飾を受けたタンパク質の断片、すなわちリポペプチドが新たな獲得免疫のターゲットになったら面白いのでは、と考えたのであった。さっそくアカゲザルエイズモデルを用いた検証作業に入る。Nefリポペプチド特異的CD8陽性T細胞が樹立できた。簡単にCD1拘束性が示せるかと思ったが、どうやってもポジティブな結果が得られない。いまから思うと、少し落とし穴があって、MHC拘束性も見えなかった。新しい抗原提示分子の存在を確信し、リポペプチド特異的T細胞応答を阻害するモノクローナル抗体を多数得て、そこから抗原提示分子を認識する抗体を探すことになる。結果、MHCクラス1分子を認識するモノクローナル抗体が得られてきたのは、なんとも遠回りで皮肉であるが、これも研究の面白さだろう。アカゲザルMHCは複雑であり、候補遺伝子の単離に難渋したが、ようやくfull-length cDNAが単離できた。リコンビナントタンパク質を得、cell-freeアッセイでTCRによる特異的認識を実証できた時点で、MHC分子がリポペプチドを提示する確信を得た。
最終段階は、リポペプチドを結合したMHCクラス1分子の結晶構造を解き明かすことである。結晶化の条件を決定するだけでも1年近くを要した。苦労は大きかったが、得られた結晶構造に息をのんだ。リガンドのミリスチン酸部分がきれいに折り畳まれて、本来アンカーアミノ酸が収納されるBポケットに納まっている。嵩のある疎水性のアシル鎖を収納すべく、このMHCクラス1分子のBポケットの壁面・底面には、小さな側鎖を持つアミノ酸や疎水性アミノ酸が程よく配置されていた。逆に、Fポケットは小さく、ミリスチン酸修飾にエッセンシャルなアミノ酸であるセリンをアンカー残基として収納していた(図参照)。まさに、ミリスチン酸修飾リポペプチドを提示するために進化してきたMHCクラス1アリルと言って過言ではない。
リポペプチド免疫パラダイムの確立に向けた第一歩が踏み出されたと思う。杉田研らしいコツコツとした努力を積み重ねれば、少し時間はかかるかもしれないが、ゴールが見えてくるだろう。そう確信した1年であった。
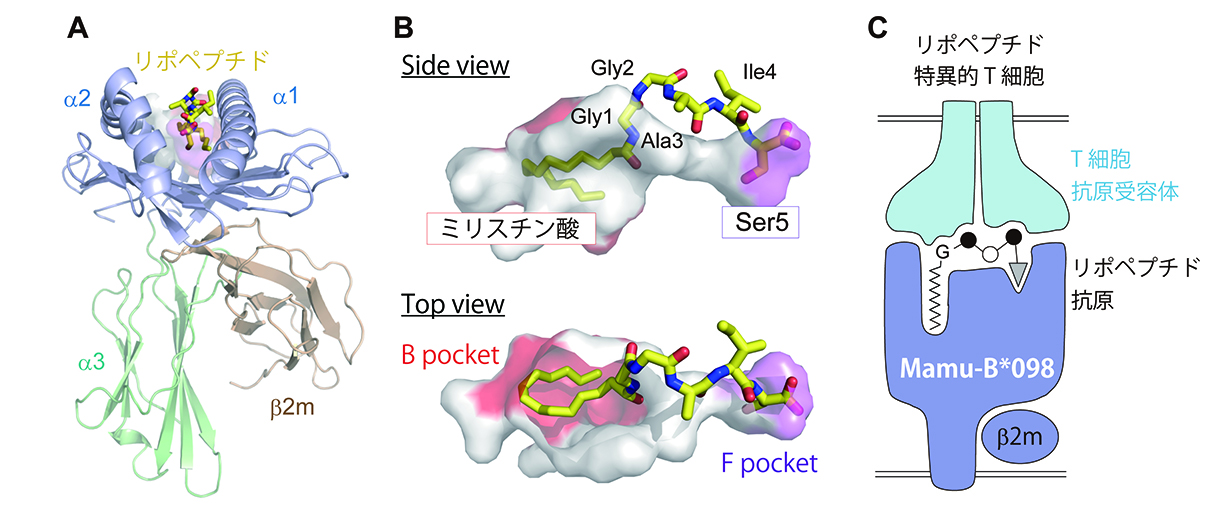
図. リポペプチドの抗原提示様式 A. MHCクラス1:リポペプチド複合体の全体構造(解像度1.76Å)。 B. 抗原結合溝の構造。リポペプチド(黄色スティック)の両末端、ミリスチン酸とC末端アミノ酸(セリン)残基が溝内に深く収納されており、アンカーとして機能する(上図)。ミリスチン酸は大きく疎水性の高いBポケット(赤色)、C末端アミノ酸は親水性の小さなFポケット(紫色)に収納される(下図)。 C. リポペプチド抗原提示モデル。両末端がMHCクラス1分子への結合に関わり、ペプチド中央の3アミノ酸がT細胞の認識に関わる。
