エッセイ
うちのとくいわざ:免疫研究と脂質生化学研究の融合 ~脂質免疫の解明に向けて~
はじめに
「うちのとくいわざ」に寄稿するよう、ニュースレター編集長の安友康二先生よりご指示をいただいた。「次世代・・」「三次元・・」「多光子・・」「リアルタイム・・」などの頭文字が付されたテクノロジーがルーティーンに活用されつつある今日この頃である。モルモット(マウスではない)やアカゲザルなどの個体(遺伝子改変ではない)を用いた免疫解析、薄層クロマトグラフィーやマススペクトロメトリを主体とした脂質生化学解析など、愚直なまでにクラシカルテクノロジーに固執しているわが研究室に「とくいわざ」を見いだすことは容易ではない。しかし一方、水に全く溶けないlipidicな抗原に対する新しい獲得免疫応答の本態を解明しようとする研究には、それなりの工夫と発見があり、日本免疫学会の若い研究者の皆さんにもそれなりの目新しさがあると思うのでここで紹介したい。
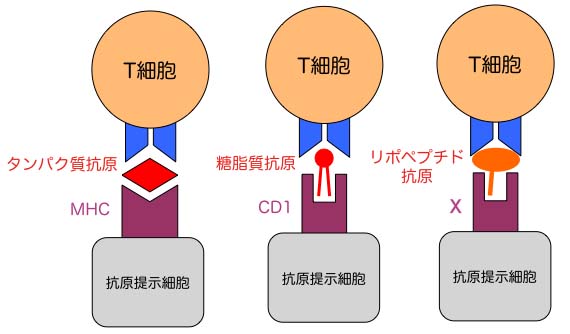
獲得免疫の標的はタンパク質だけではない
「獲得免疫を担うαβT細胞群が認識する抗原はタンパク質(ペプチド)である」との理解は正しくない。結核菌やエイズウイルスは、感染の成立に伴い、宿主由来の基質を利用して新たにlipidicな分子を生合成する。多くの場合、これらの分子は免疫抑制的に働き、病原体のエスケープ機構として理解される。私たちの最近の研究から、病原体のエスケープに働くこれらのlipidicな分子に対してT細胞応答が誘起されることが明らかとなった。それはタンパク質(ペプチド)とは異質の第二、第三の抗原レパートリーが存在することを意味する。
第二の抗原レパートリー「糖脂質」~結核菌を例として~
フロイントアジュバントの主要な活性成分はトレハロースジミコール酸(TDM)という細胞壁糖脂質である。Mincleや他の自然免疫受容体を介して、自然免疫細胞を強力に刺激する。病原性結核菌は、宿主体内に高濃度で存在するグルコースをミコール酸転移酵素の競合的基質として利用し、自然免疫刺激活性の乏しい新たな糖脂質(グルコースモノミコール酸:GMM)を新生するとともに、TDMの産生を抑制する。すなわちこの糖脂質置換反応は、宿主自然免疫からのエスケープ機構として有効に機能する。一方、宿主獲得免疫は、このGMMを標的としたCD1拘束性T細胞応答を誘起する(マウスやラットにはこの免疫システムがない)。BCG免疫モルモットやサルに、リポソームに封入したGMMを皮内接種すると、Th1にシフトした遅延型アレルギー応答(IV型アレルギー)が観察される1)。このことは、GMMに対するメモリーT細胞応答が宿主内増殖結核菌の特異的制御に働く可能性を示唆するとともに、遅延型アレルギー応答の標的が教科書に記載されているようなタンパク質だけではないことを意味している。
第三の抗原レパートリー「リポペプチド」~エイズウイルスを例として~
エイズウイルスNefタンパク質は、宿主由来の基質(ミリスチン酸)と酵素(ミリスチン酸転移酵素)を利用した脂肪酸修飾を受け、膜にアンカーすることにより免疫抑制機能を発揮する。サルエイズウイルスに感染したアカゲザルの解析から、宿主はこのミリスチン酸付加Nefタンパク質に対するキラーT細胞応答を誘起できることが明らかとなった2)。標的抗原はNefタンパク質のN末端に存在する5個のアミノ酸からなるペプチドであり、そのN末グリシン残基にミリスチン酸が付加されていることが抗原活性に必須であった。このペプチド配列にはミリスチン酸付加シグナルが包含されているため、ウイルスがNefタンパク質機能を損なうことなく変異を導入することが困難である。すなわち、このリポペプチドを標的としたT細胞応答は、病原体のエスケープを許容しない感染制御機構であると言える。リポペプチドを提示する抗原提示分子は未同定だが、現在やはりクラシカルテクノロジーに固執してその同定を進めている。
おわりに
おそらく一般的な免疫研究は、主としてマウスやラットを用い、水に溶ける(あるいは溶けやすい)物質を対象とする場合が多い。上述のミコール酸は炭素数が80以上にも及ぶ脂肪酸であり、どうやって培養系に導入するか、どうやって生体に投与するか、工夫することになる。免疫学と脂質生化学を高いレベルで有機的に融合し、「脂質免疫」の実態解明に取り組む研究は、単なる新しいテクノロジーの導入では簡単に解決しない分、苦労と面白みがあるのである。
<参考文献>
1) Komori T, et al. J. Biol. Chem. 286: 16800-16806, 2011.
2) Morita D, et al. J. Immunol. 187: 608-612, 2011.